LEY BOYLE-MARIOTTE
La Ley de Boyle-Mariotte, o Ley de Boyle, formulada independientemente por el físico y químico irlandés Robert Boyle (1662) y el físico y botánico francés Edme Mariotte (1676), es una de las leyes de los gases que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que:
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante.o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce.Matemáticamente se puede expresar así:
donde
 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante
 para poder hacer uso de la ley: si consideramos las dos situaciones de
la figura, manteniendo constante la cantidad de gas y la temperatura,
deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de
la figura, manteniendo constante la cantidad de gas y la temperatura,
deberá cumplirse la relación:Además, si se despeja cualquier incógnita se obtiene lo siguiente:
LEY DE CHARLES
La Ley de Charles y Gay-Lussac, o simplemente Ley de Charles, es una de las leyes de gases . Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenida a una presion constante, mediante una constante de proporcionalidad directa.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energia cinetica debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Gay Lussac en 1803, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energia cinetica debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Gay Lussac en 1803, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
 De acuerdo con el enunciado, la ley de Charles puede expresarse matemáticamente de la siguiente manera:
De acuerdo con el enunciado, la ley de Charles puede expresarse matemáticamente de la siguiente manera:V1.T2 = V2.T1 (P=cte)
En donde:
V= Volumen.
T= Temperatura.
P= Presión, la cual es constante.
Observa la aplicación de dicha expresión a través de los siguientes ejemplos:
1. A 1,5 atmósferas y 25 °C el volumen de un gas es de 600 cm3, si la presión permanece inalterable ¿Cuál será el volumen del gas a 20 °C?
· Primer paso: Identificar los datos que se dan en el enunciado.
P1= 1,5 atm (cte)
T1= 25°C
V1= 600 cm3
T2= 20 °C
· Segundo paso: Conocer cual es la igcognita o interrogante.
V2= ?
· Tercer paso: Despejar V2 de la expresión: V1.T2 = V2.T1, quedando así:
V2= V1.T2
T1
· Cuarto paso: Transformar °C a K, de la siguiente manera:
T1: K= °C + 273 T2: K= °C + 273
K= 25 + 273= 298 K K= 20 + 273= 293 K
· Finalmente se sustituyen los valores y se realiza el calculo matemático.
V2= 600 cm3 . 293 K
298 K
Se cancelan las unidades (Kelvin) y se obtiene el resultado:
V2= 589,93cm3
2. Se tienen 0,2 litros de un gas a 30 °C y una atmósfera de presión ¿Qué temperatura hay que aplicarle para que aumente a 0,3 litros?
· Primer paso: Identificar los datos que se dan en el enunciado.
 V1= 0,2 L
V1= 0,2 LT1= 30 °C
P= 1 atm (cte)
V2= 0,3 L
· Segundo paso: Conocer cual es la igcognita o interrogante.
T2= ?
· Tercer paso: Despejar T2 de la expresión: V1.T2 = V2.T1, quedando así:
T2= V2.T1
V1
· Cuarto paso: Transformar °C a K, de la siguiente manera:
T1: K= °C + 273
K= 30 + 273= 303 K
· Finalmente se sustituyen los valores y se realiza el calculo matemático.
T2= 0.3 L . 303 K
0,2 L
Se cancelan las unidades (litros) y se obtiene el resultado:
LEY GAY-LUSSAC
establece que la presión de un volumen fijo de un gas, es directamente proporcional a su temperatura.
Si el volumen de una cierta cantidad de gas a presión moderada se mantiene constante, el cociente entre presión y temperatura (kelvin) permanece constante:
\frac{P}{T} =k_3
o también:
P = k_3T \qquad

donde:
P es la presión
T es la temperatura absoluta (es decir, medida en kelvin)
k3 una constante de proporcionalidad
Si el volumen de una cierta cantidad de gas a presión moderada se mantiene constante, el cociente entre presión y temperatura (kelvin) permanece constante:
\frac{P}{T} =k_3
o también:
P = k_3T \qquad

donde:
P es la presión
T es la temperatura absoluta (es decir, medida en kelvin)
k3 una constante de proporcionalidad
Esta Ley fue enunciada por
Joseph Louis Gay-Lussac a
principios de 1800. Establece que la presión de un volumen fijo de gas,
es directamente proporcional a su temperatura.
¿Por qué ocurre esto?
Al aumentar la temperatura, las moléculas del
gas se mueven más rápidamente y por tanto aumenta el número de choques contra
las paredes, es decir aumenta la presión ya que el recipiente es de paredes
fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que en cualquier momento
de este proceso, el cociente entre la presión y la temperatura siempre tenía el
mismo valor:
Supongamos que tenemos un gas que se encuentra
a una presión P1 y a una temperatura T1 al comienzo del
experimento. Si aumentamos la temperatura hasta un nuevo valor T2,
entonces la presión se incrementará a P2, y se cumplirá:
AVOGADRO (VOLUMEN MORAL)
La Ley de Avogadro (a veces llamada Hipótesis de Avogadro o Principio de Avogadro) es una de las leyes de los gases ideales. Toma el nombre de Amedeo Avogadro, quien en 1811 afirmó que:
En iguales condiciones de presión y temperatura las densidades relativas de los cuerpos gaseosos son proporcionales a sus pesos atómicos.1Y sugirió la hipótesis:
Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas.
ECUACION GAS IDEAL
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante. o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce. Matemáticamente se puede expresar así:
- PV=k
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante k para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
P1V1 = P2V2
Ley de Graham (efusión del gas)
La ley de Graham, formulada en 1829 por el químico británico Thomas Graham, establece que las velocidades de difusión y efusión de los gases son inversamente proporcionales a las raíces cuadradas de sus respectivas masas molares.
{\mbox{v}_1 \over \mbox{v}_2}=\sqrt{M_2 \over M_1}
Siendo v las velocidades y M las masas molares.
Efusión es el flujo de partículas de gas a través de orificios estrechos o poros.
Se hace uso de este principio en el método de efusión de separación de isótopos.
El fenómeno de efusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia se distribuyen uniformemente en el espacio libre. Si hay una concentración mayor de partículas en un punto habrá más choques entre sí, por lo que hará que se muevan hacia las regiones de menor número: las sustancias se efunden de una región de mayor concentración a una región de menor concentración.
{\mbox{v}_1 \over \mbox{v}_2}=\sqrt{M_2 \over M_1}
Siendo v las velocidades y M las masas molares.
Efusión es el flujo de partículas de gas a través de orificios estrechos o poros.
Se hace uso de este principio en el método de efusión de separación de isótopos.
El fenómeno de efusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia se distribuyen uniformemente en el espacio libre. Si hay una concentración mayor de partículas en un punto habrá más choques entre sí, por lo que hará que se muevan hacia las regiones de menor número: las sustancias se efunden de una región de mayor concentración a una región de menor concentración.
Dalton (presiones parciales
La ley de las presiones parciales (conocida también como ley de Dalton) fue formulada en el año 1801 por el físico, químico y matemático británico John Dalton. Establece que la presión de una mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones parciales que ejercería cada uno de ellos si sólo uno ocupase todo el volumen de la mezcla, sin variar la temperatura. La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla.
Se puede hacer una definición de la teoría mediante la aplicación de matemáticas, la presión de una mezcla de gases puede expresarse como una suma de presiones mediante:
P_{\rm total} = \sum_{i=1} ^ n {p_i} o igual P_{\text{total}} = p_1 +p_2 + \cdots + p_n
Donde p_{1},\ p_{2},\ p_{n} representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
\ P_{i} =P_{\rm total}X_i
donde X_i es la fracción molar del i-ésimo componente de la mezcla total de los m componentes. La relación matemática así obtenida es una forma de poder determinar analíticamente el volumen basado en la concentración de cualquier gas individualmente en la mezcla.
P_i =\frac{P_{\rm total}C_i}{1,000,000}
Donde la expresión: C_i es la concentración del i-ésimo componente de la mezcla expresado en unidades de ppm.
P_{\rm total} = \sum_{i=1} ^ n {p_i} o igual P_{\text{total}} = p_1 +p_2 + \cdots + p_n
Donde p_{1},\ p_{2},\ p_{n} representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
\ P_{i} =P_{\rm total}X_i
donde X_i es la fracción molar del i-ésimo componente de la mezcla total de los m componentes. La relación matemática así obtenida es una forma de poder determinar analíticamente el volumen basado en la concentración de cualquier gas individualmente en la mezcla.
P_i =\frac{P_{\rm total}C_i}{1,000,000}
Donde la expresión: C_i es la concentración del i-ésimo componente de la mezcla expresado en unidades de ppm.


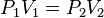
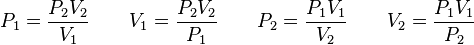

No hay comentarios:
Publicar un comentario